- ATPases
- ATPasesATPASES (adénosine-tri-phosphatases)Ces enzymes hydrolysent l’ATP par la réaction réversible:
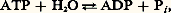 Pi étant le phosphate inorganique.Leur fonctionnement est intimement lié aux problèmes cruciaux de la bioénergétique. La molécule d’ATP est en effet «riche en énergie». L’hydrolyse de cette molécule (par les ATPases) fournit de l’énergie libre , utilisable notamment pour le transport actif des ions ou de certains métabolites à travers les membranes. D’autre part, la biosynthèse endergonique de l’ATP (dans les chloroplastes ou les mitochondries) est assurée par le fonctionnement réversible de certaines ATPases; dans ce cas, ce sont les gradients de protons créés par les transferts d’électrons dans les membranes qui forcent les ATPases à fabriquer de l’ATP.Nous passerons brièvement en revue dans cet article trois types d’ATPases.ATPase «réversible» de la mitochondrie . Dès 1945, Lardy et Elvehsem avaient proposé un lien entre la phosphorylation oxydative et l’activité ATPasique des membranes mitochondriales. Vers 1960, Racker et ses collaborateurs isolèrent de mitochondries de cœur de bœuf un facteur soluble 1, possédant une activité ATPasique, mais rétablissant par ailleurs les propriétés phosphorylantes de particules submitochondriales obtenues par fragmentation mécanique des mitochondries. Ces particules, recueillies seules par centrifugation, oxydaient le succinate sans synthétiser l’ATP; mises en présence du facteur soluble 1, elles oxydaient le succinate et réalisaient simultanément la synthèse endergonique de l’ATP: le facteur F1 apparaissait donc comme un facteur de couplage .Ce facteur 1 est une ATPase «réversible» dont le poids moléculaire est 360 kilodaltons. L’enzyme comporte cinq sous-unités peptidiques différentes, de poids moléculaires respectivement 60, 57, 36, 12,5 et 7,5 kilodaltons; le nombre exact de chacune de ces sous-unités n’est pas encore clairement précisé. L’activité ATPasique est inhibée par l’azoture de sodium; l’activité de biosynthèse de l’ATP ne se manifeste que dans les conditions précisées ci-dessous et peut être inhibée par l’oligomycine.L’ATPase manifeste des propriétés «allotopiques». Quand le facteur 1 est lié à la membrane interne de la mitochondrie, il apparaît en microscopie électronique (après «coloration négative» à l’acide phosphotungstique) sous forme de sphères protubérantes de 8,5 nm de diamètre, rattachées à la membrane par des pédicelles fins faisant face à la matrice. Dans cette situation, l’ATPase peut fonctionner réversiblement et l’enzyme est inhibée par l’oligomycine. Si l’on traite les membranes internes des mitochondries par de l’urée ou de la trypsine, les sphères de 8,5 nm de diamètre se détachent; l’ATPase ne fonctionne plus que dans le sens de l’hydrolyse de l’ATP et l’enzyme devient insensible à l’oligomycine. On appelle précisément «allotopie» ce changement de propriété d’une enzyme membranaire qui se manifeste lorsque l’enzyme est isolée de la membrane.Racker et ses collaborateurs réussirent à faire fonctionner in vitro des systèmes reconstitués de phosphorylation oxydative. Ces systèmes comprenaient une membrane artificielle de phospholipides, vésiculée, dans laquelle étaient inclus des oxydases, des transporteurs d’hydrogène et d’électrons et une ATPase (F1). L’oxydation d’un substrat provoquait un gradient de protons transmembranaire et l’ATPase fonctionnait dans le sens de la biosynthèse de l’ATP sous l’effet de ce gradient, conformément à la théorie de Mitchell. Les agents découplants (Dinitrophénol, Valinomycine, détergents) paralysaient l’ATPase dans ces systèmes reconstitués, comme dans les mitochondries.ATPase «réversible» du chloroplaste . Le premier facteur de couplage du chloroplaste (CF1, coupling factor 1 ) fut décrit par Avron en 1963. Des chloroplastes traités par une solution d’acide éthylène-diamine-tétraacétique (EDTA) perdent leurs capacités de photophosphorylation. Ces capacités peuvent être reconstituées en rajoutant aux chloroplastes traités par l’EDTA le liquide d’extraction et du magnésium. On a par la suite purifié, à partir de ce liquide d’extraction, la protéine nommée C1, qui s’est révélée être une ATPase stimulée par les ions Ca2+ ou Mg2+.Observées au microscope électronique, après «coloration négative» à l’acide phosphotungstique, les membranes chloroplastiques présentent des protubérances constituées de sphères pédicellées, ayant 9 nm de diamètre. Après traitement de l’EDTA, les sphères se détachent des membranes et passent dans le liquide d’extraction. Lors de la reconstitution des activités de photophosphorylation, on observe le rattachement des petites sphères aux pédicelles fixés sur les membranes. Ces expériences montrent que les C1 ou ATPases réversibles des chloroplastes sont des agrégats sphériques de protéines, attachés aux membranes des thylakoïdes en face de la matrice interne de ces vésicules membranaires.L’ATPase réversible du chloroplaste possède des propriétés «allotopiques», comme l’enzyme homologue de la membrane interne des mitochondries: séparée de la membrane, l’enzyme n’agit que dans le sens de l’hydrolyse de l’ATP; attachée à la membrane, l’enzyme peut catalyser la formation endergonique de l’ATP.L’ATPase (CF1) du chloroplaste compte cinq sous-unités peptidiques 見, 廓, 塚, 嗀, 﨎, de poids moléculaires respectifs 59, 56, 37, 17,5 et 13 kilodaltons. Une formule de constitution proposée par Nelson (1977) pour cette enzyme est la suivante:
Pi étant le phosphate inorganique.Leur fonctionnement est intimement lié aux problèmes cruciaux de la bioénergétique. La molécule d’ATP est en effet «riche en énergie». L’hydrolyse de cette molécule (par les ATPases) fournit de l’énergie libre , utilisable notamment pour le transport actif des ions ou de certains métabolites à travers les membranes. D’autre part, la biosynthèse endergonique de l’ATP (dans les chloroplastes ou les mitochondries) est assurée par le fonctionnement réversible de certaines ATPases; dans ce cas, ce sont les gradients de protons créés par les transferts d’électrons dans les membranes qui forcent les ATPases à fabriquer de l’ATP.Nous passerons brièvement en revue dans cet article trois types d’ATPases.ATPase «réversible» de la mitochondrie . Dès 1945, Lardy et Elvehsem avaient proposé un lien entre la phosphorylation oxydative et l’activité ATPasique des membranes mitochondriales. Vers 1960, Racker et ses collaborateurs isolèrent de mitochondries de cœur de bœuf un facteur soluble 1, possédant une activité ATPasique, mais rétablissant par ailleurs les propriétés phosphorylantes de particules submitochondriales obtenues par fragmentation mécanique des mitochondries. Ces particules, recueillies seules par centrifugation, oxydaient le succinate sans synthétiser l’ATP; mises en présence du facteur soluble 1, elles oxydaient le succinate et réalisaient simultanément la synthèse endergonique de l’ATP: le facteur F1 apparaissait donc comme un facteur de couplage .Ce facteur 1 est une ATPase «réversible» dont le poids moléculaire est 360 kilodaltons. L’enzyme comporte cinq sous-unités peptidiques différentes, de poids moléculaires respectivement 60, 57, 36, 12,5 et 7,5 kilodaltons; le nombre exact de chacune de ces sous-unités n’est pas encore clairement précisé. L’activité ATPasique est inhibée par l’azoture de sodium; l’activité de biosynthèse de l’ATP ne se manifeste que dans les conditions précisées ci-dessous et peut être inhibée par l’oligomycine.L’ATPase manifeste des propriétés «allotopiques». Quand le facteur 1 est lié à la membrane interne de la mitochondrie, il apparaît en microscopie électronique (après «coloration négative» à l’acide phosphotungstique) sous forme de sphères protubérantes de 8,5 nm de diamètre, rattachées à la membrane par des pédicelles fins faisant face à la matrice. Dans cette situation, l’ATPase peut fonctionner réversiblement et l’enzyme est inhibée par l’oligomycine. Si l’on traite les membranes internes des mitochondries par de l’urée ou de la trypsine, les sphères de 8,5 nm de diamètre se détachent; l’ATPase ne fonctionne plus que dans le sens de l’hydrolyse de l’ATP et l’enzyme devient insensible à l’oligomycine. On appelle précisément «allotopie» ce changement de propriété d’une enzyme membranaire qui se manifeste lorsque l’enzyme est isolée de la membrane.Racker et ses collaborateurs réussirent à faire fonctionner in vitro des systèmes reconstitués de phosphorylation oxydative. Ces systèmes comprenaient une membrane artificielle de phospholipides, vésiculée, dans laquelle étaient inclus des oxydases, des transporteurs d’hydrogène et d’électrons et une ATPase (F1). L’oxydation d’un substrat provoquait un gradient de protons transmembranaire et l’ATPase fonctionnait dans le sens de la biosynthèse de l’ATP sous l’effet de ce gradient, conformément à la théorie de Mitchell. Les agents découplants (Dinitrophénol, Valinomycine, détergents) paralysaient l’ATPase dans ces systèmes reconstitués, comme dans les mitochondries.ATPase «réversible» du chloroplaste . Le premier facteur de couplage du chloroplaste (CF1, coupling factor 1 ) fut décrit par Avron en 1963. Des chloroplastes traités par une solution d’acide éthylène-diamine-tétraacétique (EDTA) perdent leurs capacités de photophosphorylation. Ces capacités peuvent être reconstituées en rajoutant aux chloroplastes traités par l’EDTA le liquide d’extraction et du magnésium. On a par la suite purifié, à partir de ce liquide d’extraction, la protéine nommée C1, qui s’est révélée être une ATPase stimulée par les ions Ca2+ ou Mg2+.Observées au microscope électronique, après «coloration négative» à l’acide phosphotungstique, les membranes chloroplastiques présentent des protubérances constituées de sphères pédicellées, ayant 9 nm de diamètre. Après traitement de l’EDTA, les sphères se détachent des membranes et passent dans le liquide d’extraction. Lors de la reconstitution des activités de photophosphorylation, on observe le rattachement des petites sphères aux pédicelles fixés sur les membranes. Ces expériences montrent que les C1 ou ATPases réversibles des chloroplastes sont des agrégats sphériques de protéines, attachés aux membranes des thylakoïdes en face de la matrice interne de ces vésicules membranaires.L’ATPase réversible du chloroplaste possède des propriétés «allotopiques», comme l’enzyme homologue de la membrane interne des mitochondries: séparée de la membrane, l’enzyme n’agit que dans le sens de l’hydrolyse de l’ATP; attachée à la membrane, l’enzyme peut catalyser la formation endergonique de l’ATP.L’ATPase (CF1) du chloroplaste compte cinq sous-unités peptidiques 見, 廓, 塚, 嗀, 﨎, de poids moléculaires respectifs 59, 56, 37, 17,5 et 13 kilodaltons. Une formule de constitution proposée par Nelson (1977) pour cette enzyme est la suivante: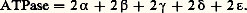 Lors des photophosphorylations, les transferts d’électrons dans les membranes ou bien les gradients de protons qui en résultent déterminent des changements conformationnels dans les ATPases chloroplastiques: ces agrégats protéiques acquièrent ainsi à la lumière un «état énergisé» qui dégage le site actif permettant la biosynthèse endergonique de l’ATP.ATPases liées au transport actif des ions . Deux systèmes de transport actif ont été particulièrement bien étudiés dans les tissus animaux: en premier lieu le système ATPasique transportant les ions Na+ et K+, et en second lieu le système de transport intracellulaire des ions Ca2+, que nous allons successivement décrire.La plupart des cellules animales ont des concentrations intracellulaires en ions K+ élevées (120 à 160 mM) tandis que la concentration intracellulaire en ions Na+ est habituellement beaucoup plus faible (inférieure à 10 mM). Cette situation est réalisée par une expulsion active des ions Na+ hors de la cellule et une absorption active simultanée d’ions K+. Le système enzymatique responsable de ces transports actifs est une ATPase dite (Na+ + K+) dépendante liée au plasmalemme des cellules. Il faut souligner que les gradients transmembranaires de K+ et de Na+ sont principalement responsables du maintien du «potentiel de membrane» qui dans les cellules nerveuses sert de support au passage de l’influx nerveux. Lorsque passe cet influx le long du plasmalemme d’un neurone, un potentiel d’action apparaît, marqué par une décharge transitoire du potentiel de membrane; cette décharge est provoquée par une augmentation rapide de la perméabilité de la membrane de la cellule nerveuse aux ions Na+ et K+, quand elle est stimulée ou excitée.Sur les plasmalemmes de cellules nerveuses de crabes, Skou a découvert une ATPase exigeant les ions Mg2+, fortement stimulée par l’addition simultanée d’ions Na+ et K+, alors que l’addition isolée de l’un de ces ions ne produit qu’une faible stimulation. Cette ATPase du plasmalemme est inhibée par un glycoside tonicardiaque, l’ouabaïne . On a trouvé de grandes quantités de cette ATPase stimulée par Na+ et K+ dans les cellules très excitables (nerfs, muscles, cerveau, organe électrique du poisson torpille Electrophorus electricus ). Les cellules du cortex surrénal ou bien celles des glandes à sel des oiseaux marins sont également riches en ATPase.Le fonctionnement de l’ATPase stimulée par les ions Na+ et K+ a été bien étudié sur la membrane des globules rouges des Vertébrés. Les transports d’ions couplés à l’hydrolyse de l’ATP sont strictement orientés. L’équation stoechiométrique suivante résume le fonctionnement global du système ATPasique du plasmalemme:
Lors des photophosphorylations, les transferts d’électrons dans les membranes ou bien les gradients de protons qui en résultent déterminent des changements conformationnels dans les ATPases chloroplastiques: ces agrégats protéiques acquièrent ainsi à la lumière un «état énergisé» qui dégage le site actif permettant la biosynthèse endergonique de l’ATP.ATPases liées au transport actif des ions . Deux systèmes de transport actif ont été particulièrement bien étudiés dans les tissus animaux: en premier lieu le système ATPasique transportant les ions Na+ et K+, et en second lieu le système de transport intracellulaire des ions Ca2+, que nous allons successivement décrire.La plupart des cellules animales ont des concentrations intracellulaires en ions K+ élevées (120 à 160 mM) tandis que la concentration intracellulaire en ions Na+ est habituellement beaucoup plus faible (inférieure à 10 mM). Cette situation est réalisée par une expulsion active des ions Na+ hors de la cellule et une absorption active simultanée d’ions K+. Le système enzymatique responsable de ces transports actifs est une ATPase dite (Na+ + K+) dépendante liée au plasmalemme des cellules. Il faut souligner que les gradients transmembranaires de K+ et de Na+ sont principalement responsables du maintien du «potentiel de membrane» qui dans les cellules nerveuses sert de support au passage de l’influx nerveux. Lorsque passe cet influx le long du plasmalemme d’un neurone, un potentiel d’action apparaît, marqué par une décharge transitoire du potentiel de membrane; cette décharge est provoquée par une augmentation rapide de la perméabilité de la membrane de la cellule nerveuse aux ions Na+ et K+, quand elle est stimulée ou excitée.Sur les plasmalemmes de cellules nerveuses de crabes, Skou a découvert une ATPase exigeant les ions Mg2+, fortement stimulée par l’addition simultanée d’ions Na+ et K+, alors que l’addition isolée de l’un de ces ions ne produit qu’une faible stimulation. Cette ATPase du plasmalemme est inhibée par un glycoside tonicardiaque, l’ouabaïne . On a trouvé de grandes quantités de cette ATPase stimulée par Na+ et K+ dans les cellules très excitables (nerfs, muscles, cerveau, organe électrique du poisson torpille Electrophorus electricus ). Les cellules du cortex surrénal ou bien celles des glandes à sel des oiseaux marins sont également riches en ATPase.Le fonctionnement de l’ATPase stimulée par les ions Na+ et K+ a été bien étudié sur la membrane des globules rouges des Vertébrés. Les transports d’ions couplés à l’hydrolyse de l’ATP sont strictement orientés. L’équation stoechiométrique suivante résume le fonctionnement global du système ATPasique du plasmalemme: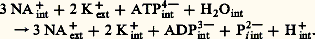 L’ATP ne peut être utilisé que s’il est fourni du côté interne (cytoplasmique). Les ions Mg2+ sont nécessaires parce que le vrai substrat de l’enzyme est le complexe MgATP. Au cours du transport actif des ions Na+ et K+, l’enzyme est transitoirement phosphorylée. Expérimentalement, on a pu induire un fonctionnement réversible (tout à fait artificiel) de l’ATPase du plasmalemme en établissant des flux d’ions inverses des flux naturels (K+ sortant des cellules et Na+ y entrant). Ainsi un gradient électrochimique de Na+ et K+ à travers la membrane des érythrocytes peut provoquer la synthèse d’ATP tout comme les gradients de protons à travers les membranes des mitochondries et des chloroplastes.L’ATPase (Na+ + K+) dépendante a été isolée et purifiée à partir de divers tissus animaux. Son poids moléculaire est de 250 à 300 kilodaltons. Elle contient deux sous-unités peptidiques de poids moléculaires respectifs 130 et 50 kilodaltons. La grande sous-unité est phosphorylée en cours de transport actif. Elle porte des sites de fixation pour les ions Na+, K+ et l’ATP ou l’ouabaïne; c’est une protéine intégrée traversant toute l’épaisseur du plasmalemme. La petite sous-unité est une glycoprotéine contenant de l’acide sialique et des résidus de glucose et galactose. Certains phospholipides constituent un anneau lipidique autour de l’ATPase et sont nécessaires pour que l’enzyme prenne in situ sa conformation opérationnelle. Les cellules de rein ou du cerveau utilisent 70 p. 100 de l’ATP produit par leurs mitochondries pour le transport actif des ions Na+ et K+.Une ATPase stimulée par les ions Ca2+ a été isolée des membranes du réticulum endoplasmique ou sarcoplasmique des fibres musculaires. Ce système a été étudié en détail par Hasselbach et ses collaborateurs, grâce à l’utilisation de vésicules «rescellées» après fragmentation du réticulum sarcoplasmique. Les ATPases des membranes sarcoplasmiques assurent le transport actif du calcium vers l’intérieur des vésicules en hydrolysant de l’ATP: deux ions Ca2+ sont transportés à l’intérieur des vésicules pour chaque molécule d’ATP hydrolysée. L’ATPase stimulée par Ca2+ ou Mg2+ forme environ 80 p. 100 de la masse des protéines membranaires du réticulum sarcoplasmique. C’est une protéine intégrée à la structure membranaire, traversant toute l’épaisseur de la membrane, grossièrement cylindrique et exigeant un anneau de trente molécules de phospholipides pour prendre in situ sa conformation opérationnelle.Une activité ATPasique stimulée par le calcium est liée à la myosine du muscle.En conclusion, toutes les ATPases présentées dans cet article sont des enzymes «à propriétés vectorielles». Intégrées à diverses membranes, ces enzymes présentent toutes des conformations différentes selon les gradients de protons ou de cations existant à travers les membranes. Dans certaines conformations, ces enzymes hydrolysent l’ATP et déterminent certains flux ioniques; dans d’autres conformations, ces enzymes peuvent fort bien synthétiser de l’ATP et faciliter d’autres flux (de protons ou d’ions). La régulation de ces ATPases par la phase lipidique des membranes constitue un domaine de recherche présentement très actif.
L’ATP ne peut être utilisé que s’il est fourni du côté interne (cytoplasmique). Les ions Mg2+ sont nécessaires parce que le vrai substrat de l’enzyme est le complexe MgATP. Au cours du transport actif des ions Na+ et K+, l’enzyme est transitoirement phosphorylée. Expérimentalement, on a pu induire un fonctionnement réversible (tout à fait artificiel) de l’ATPase du plasmalemme en établissant des flux d’ions inverses des flux naturels (K+ sortant des cellules et Na+ y entrant). Ainsi un gradient électrochimique de Na+ et K+ à travers la membrane des érythrocytes peut provoquer la synthèse d’ATP tout comme les gradients de protons à travers les membranes des mitochondries et des chloroplastes.L’ATPase (Na+ + K+) dépendante a été isolée et purifiée à partir de divers tissus animaux. Son poids moléculaire est de 250 à 300 kilodaltons. Elle contient deux sous-unités peptidiques de poids moléculaires respectifs 130 et 50 kilodaltons. La grande sous-unité est phosphorylée en cours de transport actif. Elle porte des sites de fixation pour les ions Na+, K+ et l’ATP ou l’ouabaïne; c’est une protéine intégrée traversant toute l’épaisseur du plasmalemme. La petite sous-unité est une glycoprotéine contenant de l’acide sialique et des résidus de glucose et galactose. Certains phospholipides constituent un anneau lipidique autour de l’ATPase et sont nécessaires pour que l’enzyme prenne in situ sa conformation opérationnelle. Les cellules de rein ou du cerveau utilisent 70 p. 100 de l’ATP produit par leurs mitochondries pour le transport actif des ions Na+ et K+.Une ATPase stimulée par les ions Ca2+ a été isolée des membranes du réticulum endoplasmique ou sarcoplasmique des fibres musculaires. Ce système a été étudié en détail par Hasselbach et ses collaborateurs, grâce à l’utilisation de vésicules «rescellées» après fragmentation du réticulum sarcoplasmique. Les ATPases des membranes sarcoplasmiques assurent le transport actif du calcium vers l’intérieur des vésicules en hydrolysant de l’ATP: deux ions Ca2+ sont transportés à l’intérieur des vésicules pour chaque molécule d’ATP hydrolysée. L’ATPase stimulée par Ca2+ ou Mg2+ forme environ 80 p. 100 de la masse des protéines membranaires du réticulum sarcoplasmique. C’est une protéine intégrée à la structure membranaire, traversant toute l’épaisseur de la membrane, grossièrement cylindrique et exigeant un anneau de trente molécules de phospholipides pour prendre in situ sa conformation opérationnelle.Une activité ATPasique stimulée par le calcium est liée à la myosine du muscle.En conclusion, toutes les ATPases présentées dans cet article sont des enzymes «à propriétés vectorielles». Intégrées à diverses membranes, ces enzymes présentent toutes des conformations différentes selon les gradients de protons ou de cations existant à travers les membranes. Dans certaines conformations, ces enzymes hydrolysent l’ATP et déterminent certains flux ioniques; dans d’autres conformations, ces enzymes peuvent fort bien synthétiser de l’ATP et faciliter d’autres flux (de protons ou d’ions). La régulation de ces ATPases par la phase lipidique des membranes constitue un domaine de recherche présentement très actif.
Encyclopédie Universelle. 2012.
